朱头山
无意邀众赏,一心追残阳上周写了《阿兹海默症与药物》一文,在博客和论坛栏目总共收获近八千人次的点击。对此深受鼓舞,接着写阿兹海默症与药物的第二篇,关于阿兹海默症病因的第二个假说:tau蛋白假说。
根据著名教科书《分子细胞生物学》[1]第1026页第22章“神经系统的细胞”中介绍:成年人的大脑重1.3千克,是存储、计算、整合和传输信息的控制中心,包含近1000亿个神经细胞,称为神经元(neurons)。这些神经元通过大约1000兆(万亿)个突触(synapses)相互连接,突触是两个或多个神经元进行通信的连接点。单个神经元可以与多达1万个其他神经元经突触连接。

上图中细胞体周围有神经突,包含周边的树突(Dendrites)和圆圈中的轴突(Axon)。轴突中有细胞骨架叫微管(Microtubule)。两种微管蛋白分别是450至500个氨基酸组成的线团 - 球状微管蛋白,它俩分别叫 α 和 β 型微管蛋白(tubulin),再聚合成管状原丝(protofilaments - PFs),见下图。

微管受外面的微管相关蛋白(Microtubules-associated proteins - MAP)调节。微管相关蛋白包括对神经元生长和功能至关重要的典型蛋白,如tau和MAP-2、MAP-4或MAP-6等。tau占神经元微管相关蛋白总数的80%以上,稳定并束缚着轴突微管[2]。
tau 蛋白
前面说了tau蛋白是一种轴突蛋白-微管相关蛋白,可稳定并捆扎微管。tau 蛋白有六种不同的异构体,从 352 至 441 个氨基酸残基长短不齐。下图的左半部是一种tau蛋白(细线)连接在α和β型微管蛋白(小球)上的示意图[2]。有tau蛋白的连接,微管就不会散架。

正常时 tau 蛋白的含有几种氨基酸会在蛋白激酶的作用下磷酸化。但异常或过度的磷酸化会使tau蛋白弯曲-折叠、脱落、互相粘连和抱团等。见上图的右半部。tau 的粘连和抱团形成神经元纤维缠结(Neurofibrillary tangles - NFTs),NFT 均由不溶性密集填充的蛋白丝构成。
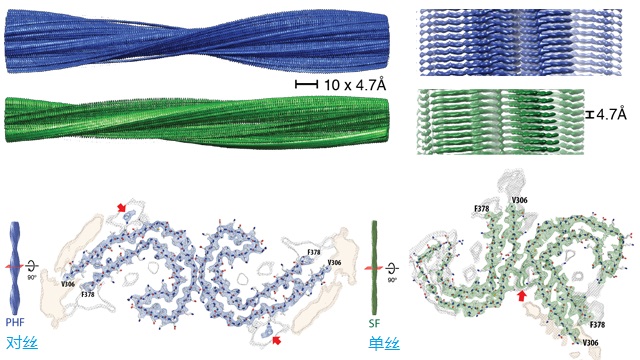
脱落的tau蛋白可以互相粘连并叠成丝,一种是成对的螺旋丝(paired helical filaments)-蓝色和直的丝(straight filaments)-绿色[3]。两者组成成分相同,只不过蛋白互联的地方不同,见下图。这些丝抱团形成神经元纤维缠结,最终导致痴呆症。见前文《阿兹海默症与药物》的图一
tau 蛋白除了出现上述的错误折叠外还可能出现其它位置的错误折叠,如下图左半部的折叠会引起皮克氏(Pick's)病,也一种渐进性痴呆;右侧(同上图)的折叠引起阿兹海默病。同样是tau 蛋白折叠出不同,引发的病不同,但同样是痴呆。
基于tau疗法的药物
1,调节tau磷酸化:tau蛋白的过度磷酸化很可能是多种蛋白激酶活性的结果,减少病理性tau蛋白磷酸化的更有效靶点是特定的激酶还是不同蛋白激酶(如GSK-3β,MARK和CDK5,见下图)组合作用仍然是未知。当然,临床上最先进的蛋白激酶抑制策略是针对GSK-3β。但现有的临床试验还没有成功的例子。

2,针对其它tau翻译后修改:除磷酸化外,tau还被赖氨酸乙酰化广泛地翻译后修饰,这导致tau功能受损并促成病理性聚集,所以人们提出使用tau乙酰化抑制剂作为AD和其他Tau蛋白异常沉积(Tauopathies)的潜在治疗策略。但还没有有效的化合物。
3,微管稳定剂:tau蛋白与微管分离会导致其正常的微管稳定功能丧失,并最终导致轴突运输缺陷和突触功能障碍。一些动物试验表明一种紫杉醇小分子有稳定微管的功效。但临床试验失败。
4,tau蛋白聚集抑制剂:体外和/或基于细胞的筛选测定已找到几种能够抑制tau聚集有功效的小分子化学物系列。但在很大程度上缺乏在体内抑制tau聚集和明显改善认知的功效的证据。
TauRx公司的LMTX是一种稳定的无水还原形式的甲基硫代氯化镍,可以用作tau蛋白聚集抑制剂。2018年12月美国食品和药物管理局(FDA)已授予LMTX的孤儿药指定(ODD),用于阿兹海默病额颞痴呆(FTD)亚型的治疗,还没有被批准上市。
FDA仅授予用于治疗、诊断或预防在美国影响少于20万人或影响超过20万人但预计不会收回开发和营销成本的罕见疾病或病症的药物为ODD资格治疗药物。ODD用于鼓励赞助商开发罕见病产品。ODD药物有七年市场独占权。
5,抗tau主动免疫疗法:基于引起能够清除tau蛋白的特异性抗体反应,一些生物抗tau免疫疗法的方法已在动物模型中成功测试,表明这可能是清除Tau蛋白异常沉积的方法。
AADvac1是第一个旨在修饰tau蛋白来治愈阿茨海默氏病的活性蛋白疫苗,正在临床试验。
Gosuranemab(BIIB092)IgG4单克隆抗体,正在二期临床。
Genentech 的(RO7105705)IgG4单克隆抗体,正在二期临床。
Zagotenemab(LY3303560)单克隆抗体,2021年完成二期临床。

tau的临床诊断
显而易见为了区分不同类型的阿兹海默病要用不同的造影剂来做PET。研究人员已经筛选了数百种氟同位素化合物。有些方法正在做临床试验。
例如:比较新一代放射性正电子发射断层扫描(PET)示踪化合物氟18RO-948和MK-6240的临床试验工作(NCT03939780)计划在2023年得到最终结论。

科学家们以经有很多科研成果,但关于由tau蛋白引发阿兹海默病的假说及其发病机理和治疗药物的研究好像不是“指日可待”而是“任重道远”,我们只能“翘首以盼”。
阿兹海默病还有其它假说和防治药物吗?有没有“野路子”?
待续...
[1] Harvey Lodish et al. Molecular Cell Biology. W. H. Freeman and Company. ISBN: 978-1-4641-8339-3.
[2] Elizabeth H. Kellogg et al. Near-atomic model of microtubule-tau interactions. Science. 2018 June 15; 360(6394): 1242–1246. doi:10.1126/science.aat1780.
[3] Anthony W. P. Fitzpatrick. Cryo-EM structures of tau filaments from Alzheimer’s disease. Nature 547, 185–190 (2017). doi:10.1038/nature23002




